GRUPO 11º AB SEMANA 2 PERIODO 2
CIENCIAS NATURALES -QUÍMICA ( 10 al 14 de Mayo)2021
Institución Educativa Cristo Rey “Buscando formar jóvenes con valores sociales, culturales, científicos y técnicos” | GESTIÓN ACADÉMICA | Período: 2 |
TALLER DE ÁREA O ASIGNATURA. CIENCIAS NATURALES - QUÍMICA | Fecha:10 al 14 de Mayo | |
Semana # 2 del periodo 2 |
11 | GRUPOS | 11ºA 11ºB | DOCENTE EDILBERTO CARO ALVAREZ | CORREO 11° A 11aquimicacr@gmail.com 11° B 11bquimicacr@gmail.com |
TEMA/ EJES TEMÁTICOS |
| |
COMPETENCIAS O DERECHOS BÁSICOS DEL APRENDIZAJE |
2 – 8°. Comprende que en una reacción química se recombinan los átomos de las moléculas de los reactivos para generar productos nuevos, y que dichos productos se forman a partir de fuerzas intramoleculares (enlaces iónicos y covalentes). | |
INDICADORES DE DESEMPEÑO | Explico la relación entre la estructura de los átomos y los enlaces que realiza. Relaciono la estructura del carbono con la formación de moléculas orgánicas. | |
ACTIVIDADES DE APRENDIZAJE (TALLER) | INSTRUCCIONES GENERALES 1. Vea el vídeo y haga un resumen, para mayor comprensión y escriba la tabla para determinar si una sustancia tiene enlace iónico o covalente https://www.youtube.com/watch?v=7ms6yrnSVWA&t=1s 2. Con base en la lectura del SIGUIENTE texto, lea y escriba una síntesis en su cuaderno . a) ¿Qué tipos de mecanismo existen para formar enlaces químicos? b) ¿Cuáles son los electrones que participan en un enlace químico? Enlace químico: A excepción de casos muy raros, la materia no se desintegra espontáneamente. La desintegración se evita por las fuerzas que actúan a nivel iónico y molecular. A través de las reacciones químicas, los átomos tienden a llegar a estados más estables con menores niveles de energía potencial química. Como ya se sabe, cuando dos o más átomos se unen, forman una molécula. Esta puede estar constituida por átomos de un mismo elemento o por átomos de elementos diferentes. Surge entonces la pregunta: ¿cómo se mantienen unidos los átomos? La respuesta la dan los enlaces químicos. Un enlace químico es el resultado de la fuerza de atracción que mantiene unidos los átomos para formar moléculas. Los electrones que intervienen en el enlace son los que están ubicados en el último nivel de energía, el nivel de valencia; estos electrones pueden pasar de un átomo a otro para completar el número de electrones del último nivel y así estabilizar electrónicamente el átomo. Los átomos pueden utilizar dos mecanismos para formar enlaces químicos, dependiendo del número de electrones de valencia que poseen. Estos mecanismos son en primer lugar, de transferencia de electrones que se presenta cuando un átomo transfiere sus electrones a otro átomo permitiéndole que complete ocho en su último nivel de energía y, en segundo lugar, compartimiento de electrones que se presenta cuando dos átomos comparten uno o más electrones de valencia y así ambos completar ocho electrones. Estructuras de lewis 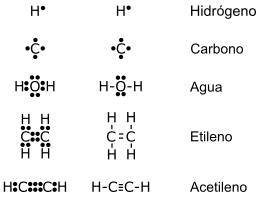 3. Escriba la configuración electrónica del ión sodio y del ión cloro. 4. Explique la formación del enlace de AlCl3 en forma de estructura de Lewis. 5. Según el siguiente texto: Qué es un enlace iónico, dar ejemplos. Enlace iónico : Cuando un átomo cede un electrón, el número de protones será mayor que el número de electrones y se generará una carga positiva (+) en el átomo, pero si gana un electrón el número de protones será menor que el número de electrones y se generará una carga negativa (-); en ambos casos se habrán formado iones. La carga del ion dependerá del número de iones cedidos o ganados; si un átomo gana dos electrones tendrá dos cargas negativas; si pierde dos electrones tendrá dos cargas positivas. Estos iones tienen cargas eléctricamente contrarias por lo cual pueden atraerse mutuamente y formar un enlace iónico, dando lugar a un compuesto iónico. El enlace químico iónico se forma por transferencia de uno o más electrones de un átomo o grupo de átomos a otro. Por lo general, la unión de un elemento metálico con un no metal es de tipo iónico 2. Estructura de lewis  6. Lea el texto y defina enlace covalente con ejemplos. Enlace covalente No todos los átomos ceden o ganan electrones cuando forman enlaces. Un enlace covalente: se forma cuando dos átomos comparten uno o más de dos pares de electrones para completar cada uno ocho electrones en su último nivel. En este enlace, no hay formación de iones y se presenta principalmente entre los no metales. Los electrones compartidos en un enlace covalente pertenecen a ambos átomos. Cada par de electrones compartidos se representa por una línea que une los dos símbolos de átomos. Ejemplo: la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (no metales).  7. Escriba : Que es un enlace covalente simple o sencillo, doble y triple, covalente polar o apolar con ejemplos. Enlace covalente simple: se forma cuando dos átomos comparten solo un par de electrones. Cl2 Enlace covalente doble: se forma cuando dos átomos comparten dos pares de electrones. Ejemplo dióxido de carbono: ejm CO2 Enlace covalente triple: se forma cuando dos átomos comparten tres pares de electrones. Ejemploel acetileno. : ejm C2 H2 Enlace covalente apolar: este tipo de enlace se da en átomos con la misma electronegatividad, los electrones compartidos son atraídos por ambos núcleos. Sin generar polos o cargas parciales. Los pares de electrones compartidos son atraídos por ambos núcleos con la misma intensidad.También se da el enlace apolar cuando la diferencia de electronegatividad es inferior a 0,5. Enlace covalente polar: cuando los átomos se enlazan, tienen una electronegatividad diferente. En la molécula se establece una zona donde se concentra una mayor densidad electrónica, originándose así un polo positivo y uno negativo. Por consiguiente, la zona que pertenece al átomo de mayor electronegatividad, será el polo negativo y la de menor electronegatividad, será la del polo positivo. La diferencia de electronegatividad entre los dos átomos de diferentes elementos del enlace polar debe ser entre 0,5 y 1,6 superior a este valor es un enlace iónico. En la figura se indican las cargas parciales (positiva y negativa) mas no se representa la carga de cada ion. HCl → H + δ----Cl – δ Enlace covalente coordinado: este enlace tiene lugar entre distintos átomos y se caracteriza porque los electrones que se comparten son aportados por uno solo de los átomos que se enlazan. El átomo que aporta el par de electrones se denomina dador y el que lo recibe, receptor. El enlace covalente coordinado se representa por medio de una flecha que parte del átomo que aporta los dos electrones y se dirige hacia el átomo que no aporta ninguno. El SO2 es una molécula en la cual se presenta un enlace covalente doble y dativo. 8. Cuál es el objeto de estudio de la química orgánica e inorgánica, escriba. Las diferencias entre química orgánica e inorgánica son:La química inorgánica: Estudia los elementos en general y su estructura Estudia la reacción e interacción entre elementos y compuestos. Se utiliza principalmente para procesos industriales y de manufactura Se forman moléculas que pueden ser pesadas, pero se comportan individualmente La química orgánica: Estudia el carbono y su relación con el hidrógeno, oxígeno, nitrógeno y azufre, principalmente Estudia el comportamiento e interacción entre las diversas sustancias orgánicas. Se utiliza para la producción de alimentos, medicamentos y combustibles Pueden combinarse unas moléculas con otras, dando como resultado nuevas moléculas con cadenas más largas 9. Escriba : Porque es importante la química orgánica? 10. Escriba las diferencias entre compuestos orgánicos e inorgánicos y las características de los compuestos orgánicos  Características de los compuestos orgánicos
Ejemplos de compuestos orgánicos
https://www.caracteristicas.co/atomo-de-carbono/ NO recibo talleres hechos en WORD. | |
FECHA Y MEDIO DE ENTREGA | 14 DE MAYO y se envía al correo de cada grupo 11° A 11aquimicacr@gmail.com 11° B 11bquimicacr@gmail.com | |
RECURSOS VIDEOS, REFERENCIAS | Cuaderno de química vídeos, Google.com www.youtube.com | |
HORA DE ATENCION PARA EL GRUPO | 11º A jueves Hora : 2.20 a 4:30 Pm 11º B Martes y jueves Hora : 1.25 a 2:20 Pm A través de videoconferencia en el link: |




No hay comentarios:
Publicar un comentario